ما هي ردة فعلك إذا علمت أن هناك ما يمكن تسخيره لعلاج آلاف، بل ملايين المرضى حول العالم ممن يعانون أمراضًا مستعصية لم يكتشف الطب لها علاجًا من قبل؟
نظريًا، يمكن للعلاج الجيني أن يستبدل الجين المعيب الذي يتسبب في الإصابة بمرض معين، بجين جديد يؤدي وظيفته الطبيعية، ما يعطي أملًا جديدًا للأفراد الذين يعانون أمراضًا وراثية، لم يسع العلم من قبل سوى السيطرة على حدة أعراضها أو تأخير حدوث مضاعفاتها.
لكن لسوء الحظ، ليس الأمر بهذه البساطة، فعلى الرغم من نجاح العديد من التجارب السريرية المعنية باختبار فاعلية ومدى سلامة العلاج الجيني على البشر، إلّا أن هناك الكثير من النتائج الكارثية لتجارب العلاج الجيني، التي لا يمكن غض الطرف عنها عند الحديث عن هذا المجال.
انتكاس العلاج الجيني في أواخر القرن الماضي
في السابع عشر من سبتمبر عام 1999، أُعلن خبر وفاة "جيسي جيلسنجر"، ذو الثمانية عشر عام، ليصبح أول ضحية معلنة لتجارب العلاج الجيني.
كان "جيلسنجر" يعاني مرض وراثي يسمى (OTCD) أو (عِوز الأورنيثين ناقل الكربامويل) الذي يتسم بنقص إنزيم معين في الجسم، نتيجة طفرة وراثية في الجين المسؤول عن تصنيع ذلك الإنزيم، ما يؤدي إلى ارتفاع مستويات الأمونيا بشكل كبير وتراكمها في الكبد والدم.
شُخص "جيلسنجر" بذلك المرض في الثانية من عمره، ونجح في السيطرة على أعراض المرض عن طريق اتباع نظام غذائي منخفض البروتين، وتناول أدويته بانتظام، حتى بلغ السابعة عشر من عمره، ليقرر التوقف عن اتباع ذلك النظام الغذائي والتوقف عن تناول أدويته، ما أدى إلى تعرضه لوعكة صحية شديدة، ليُحتجز على أثرها في المستشفى، ويدخله الأطباء في غيبوبة مستحثة، ليتمكنوا من خفض مستوى الأمونيا في الدم والسيطرة على الوضع الصحي لجيلسنجر.
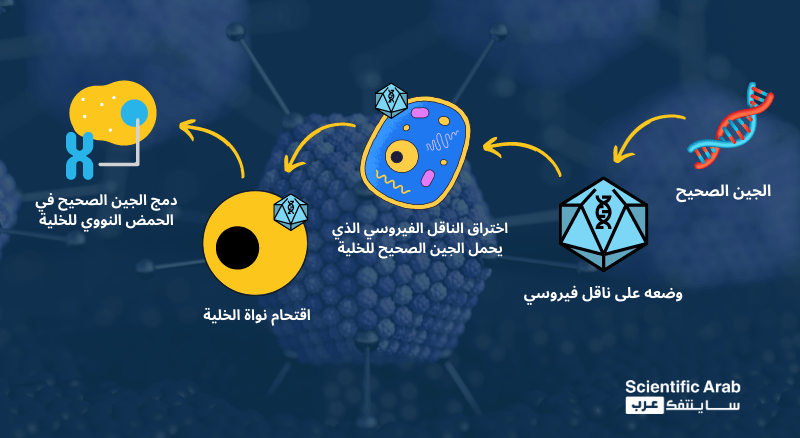
بعد تلك الوعكة الصحية، علم "جيلسنجر" بوجود تجارب سريرية لاختبار علاج محتمل لمرضه، حيث أعد الباحثون في جامعة بنسلفانيا في ولاية فيلادلفيا الأمريكية تجارب لذلك العلاج الجيني، الذي يُحقن فيه المرضى بنسخ سليمة من جين الـ(OTC)، عوضًا عن النسخة المصابة بالطفرة الوراثية، التي أدت لظهور المرض.
لكن، ولحقن هذه النسخ السليمة من الجينات والاستفادة منها، يلزم توافر ما ينقلها من خارج الخلية إلى داخلها، بل ودمجها في الحمض النووي الخاص بتلك الخلية، وهو الدور الذي تقوم به الفيروسات التي عُدلت وسُخرت لتصبح غير مؤذية للجسم البشري.
تُحقن هذه النسخ عن طريق إرفاقها بفيروسات "الأدينوفيروس" التي من شأنها أن تصيب خلايا كبد المرضى، وتدمج الجين المضاف إلى الحمض النووي الخاص بالخلايا.
لم يكن "جيلسبنجر" هو المشارك الأول في تجارب العلاج الجيني، بل سبقه ما يقرب من ١٧ مشارك في هذه التجربة، لكن بعد أربعة أيام فقط من تلقي جيلسنجر للعلاج الجيني، عانى من رد فعل مناعي كارثي، وتوفي من جرّاءِ فشل الأعضاء المتعدد، ما أدى إلى تعليق تجارب العلاج الجيني للتحقيق في أمر الحادثة، واتخاذ إجراءات تضمن سلامة المشاركين في تلك التجارب.
العلاج الجيني وسرطان الدم
لم تكن كارثة وفاة "جيلسنجر" الوحيدة من نوعها، بل تبعتها العديد من الوقائع التي شابت تقدم العلاج الجيني، أبرزها إصابة أحد المشاركين في إحدى التجارب السريرية الخاصة بعلاج أحد الأمراض المناعية، يُسمى (نقص المناعة المشترك الحاد) بسرطان الدم بعد تلقيه للعلاج الجيني.
إن نقص المناعة المشترك الحاد (SCID) هو أحد الأمراض الخطيرة، حيث يموت المصابون به صغارًا، وفي غضون السنة الأولى من حياتهم في الأغلب. لم يكن أمام هؤلاء المرضى خيارًا مسبقًا، سوى بزرع نخاع العظم من متبرع مطابق.
لكن، ظلت المعضلة في إيجاد متبرع مطابق؛ حيث إن تلقي نخاع العظم من متبرع غير مطابق يحمل في طياته زيادة المضاعفات التي قد ترفع احتمالية الإصابة بأنواع من السرطان بل ورفع معدلات الوفيات من (20-30%) وفقًا للدراسات.
ما دفع العلماء للتفكير في توفير علاج بديل لزرع النخاع العظمي، عن طريق استبدال الجين المتسبب في ذلك المرض بجين سليم، لم يلبث الأمر طويلًا، حتى حقق ذلك نجاحًا كبيرًا في الأوساط العلمية، ونجح العلماء في علاج العديد من مرضى نقص المناعة المشترك الحاد.
لكن، تأتي الرياح بما لا تشتهي السفن، فلم يستمر ذلك النجاح طويلًا، فبعد مرور عامين ونصف من تلقي أحد المشاركين للعلاج الجيني، وُجد أن عدد إحدى أنواع الخلايا المناعية بالجسم، التي يطلق عليها الخلايا التائية (T-cells) تضاعف بشكل كبير، يصل إلى عشر أضعاف المعدلات الطبيعية، فيما يشبه حالات سرطان الدم.
ما دفع العلماء للتفكير بأن عملية دمج الجين السليم باستخدام الناقل الفيروسي هي السبب وراء ذلك، ما دفع القائمون على تلك التجارب لوقف تطبيقها، لحين تحليل تلك الواقعة وتفسير آلية حدوثها، وما إذا كان تلقي العلاج الجيني هو السبب في ذلك.
لكن، على كل حال، هناك العديد من العوامل التي لا يمكن غض الطرف عنها، التي قد تكون ساهمت في تضاعف عدد الخلايا التائية في تلك الحالة إلى هذا الحد بخلاف تلقي العلاج الجيني، مثل الاستعداد الوراثي للفرد، والعدوى الفيروسية السابقة.
العلاج الجيني على مستوى الخلايا التناسلية
يهتم هذا الفرع من فروع العلاج الجيني باستهداف الخلايا المسؤولة عن تخليق الخلايا التناسلية؛ البويضات في الإناث والحيوانات المنوية في الذكور، يسمح استهداف هذه الخلايا بالسيطرة على الأمراض الوراثية التي تنتقل من جيل إلى آخر، ما يقدم أملًا كبيرًا للأفراد الذين يعانون أمراضًا وراثية ويخشون انتقالها إلى نسلهم.
لكن، يبقى هناك الكثير من الجدل بشأن التلاعب بالحمض النووي الخاص بالخلايا التناسلية، ولعل أبرز التساؤلات المطروحة بذلك الشأن هي:
هل تفوق فوائد العلاج الجيني للخلايا التناسلية المخاطر المحتملة؟
يسمح العلاج الجيني للخلايا التناسلية بتصحيح الطفرات الوراثية المسببة لأمراض عدّة، كالتي تنتقل من جيل إلى آخر، ما يضمن للأجيال القادمة بعد التدخل العلاجي حياة صحية خالية من تلك الأمراض الوراثية.
ولكن، ليس الأمر بهذه البساطة، فلا يمكن لأحد التنبؤ بالتأثيرات التي تنجم عن ذلك التعديل الجيني، بل إن الأمر قد يصل إلى إحداث طفرات وراثية أخرى، ولأن ذلك النوع من العلاج الجيني يستهدف الخلايا التناسلية، فإن أي طفرات إضافية تطرأ على الحمض النووي الخاص بتلك الخلايا سوف ينتقل -بلا شك- إلى الجيل التالي، مما يصعب السيطرة عليه.
هل العلاج الجيني على مستوى الخلايا التناسلية مقبول أخلاقيًا؟
نظريًا، يمكن تسخير العلاج الجيني، ليس فقط لحماية الأجيال القادمة من أخطار الأمراض الوراثية المختلفة، بل أيضًا لاختيار بعض الخصائص الشكلية والوظيفية للأفراد؛ مثل لون قزحية العين أو طول الأفراد أو حتى تحسين الذاكرة.
وإذا كان العلاج الجيني للأمراض الوراثية ما زال أمرًا مثيرًا للجدل والشكوك الأخلاقية في الأوساط العلمية، فإن التدخل الجيني للتحسين الوراثي الذي يتضمن التغيرات الشكلية أمر غير مقبول أخلاقيًا، وهو ما يخشاه علماء الجينات، وما قد تستغله العيادات التسويقية لاستقطاب الآباء والأمهات ب"تحسين" أبنائهم وتزويدهم ب "أحدث" الإضافات الوراثية.
هل يحترم العلاج الجيني للخلايا التناسلية حقوق الأفراد؟
أثار ذلك التساؤل جدلًا كبيرًا بين مختلف الباحثين، فالبعض ذهب رأيهم إلى أن الجنين لا يستطيع اختيار حمضه النووي الخاص ولا يستطيع اختيار الولادة بتلك الطفرات الوراثية أو بدونها. لذا، يجب على المتخصصين التدخل السريع لتصحيح تلك الطفرات وتحسين جودة حياة ذلك الجنين مستقبليًا.
في حين توجهت بعض الآراء الأخرى إلى رفض ذلك التدخل مطلقًا، حيث أنه لا يحق لأحد التدخل والتعديل الجيني لأي فرد دون الحصول على موافقة واضحة منه، وفي تلك الحالة، لا تستطع الأجنة الاختيار والموافقة على تعديل شفرتهم الوراثية، ما يبطل أحقية المتخصصين في التدخل بالعلاج الجيني للخلايا التناسلية.
أخيرًا، إن مجال العلاج الجيني أحدث طفرةً علمية في علاج الأمراض الوراثية، وأعاد الأمل لملايين المرضى الذين يعانون تلك الأمراض المستعصية. لكن، يبقى الأمر محاطًا بالجدل بشأن سلامة ذلك التدخل على المشاركين في التجارب السريرية، كما يُحاط بالغموض بشأن انتقال تلك التدخلات الجينية في الأجيال اللاحقة.